
세플리프 ®, 이온 교환 크로마토그래피에 대해 알아야 할 모든 것
이온 교환 크로마토그래피 소개:
이온교환 크로마토그래피는 이온교환체 위에서 교환 가능한 이온과 주변 매질에서 분리된 다양한 이온 사이의 정전기력 차이를 이용하여 교환평형을 통해 분리의 목적을 달성하는 컬럼 크로마토그래피 방법이다. 이온교환 크로마토그래피는 높은 감도, 반복성, 우수한 선택성, 빠른 분석 속도 등의 장점을 갖고 있으며 현재 가장 일반적으로 사용되는 크로마토그래피 방법 중 하나입니다.
1848년에 Thompson et al. 토양 내 알칼리성 물질의 교환을 연구하는 과정에서 이온교환 현상을 발견했습니다. 1940년대에는 안정적인 교환특성을 지닌 폴리스티렌 이온교환수지가 등장했다. 1950년대에는 이온 교환 크로마토그래피가 생화학 분야에 진출하여 아미노산 분석에 적용되었습니다. 현재 이온 교환 크로마토그래피는 여전히 생화학 분야에서 일반적으로 사용되는 크로마토그래피 방법으로 아미노산, 단백질, 당, 바이러스, 뉴클레오티드 등 다양한 생화학 물질의 분리 및 정제에 널리 사용됩니다.
이온 교환 과정:
이온 교환체와 용액 내 이온 또는 이온 화합물 사이의 반응은 주로 이온 교환에 의해 수행됩니다. 수행되는 이온 교환 반응은 가역적입니다. RA가 양이온 교환체를 나타낸다고 가정하면, 용액 내에서 해리된 양이온 A+는 용액 내 양이온 B+와 가역적 교환 반응을 겪을 수 있으며, 반응식은 다음과 같습니다.
RA + B+ RB + A+
반응은 매우 빠른 속도로 평형에 도달하며 평형 이동은 질량 작용의 법칙을 따릅니다.
이온 교환기의 선택성은 반응의 평형 상수 K로 표현될 수 있습니다.
K锛漑RB][A+]/[RA][B+]
✔반응 용액에서 [A+]가 [B+]와 같으면 K=[RB]/[RA]입니다.
✔K>1, 즉 [RB]>[RA]이면 B+에 대한 이온 교환체의 결합력이 A+의 결합력보다 크다는 것을 의미하며;
✔K=1, 즉 [RB]=[RA]이면 이온 교환체가 A+와 B+에 대해 동일한 결합력을 갖는다는 것을 의미하며;
✔K
✔K값은 이온교환체가 서로 다른 이온에 대한 결합력이나 선택성을 반영하는 매개변수이므로, K값을 A+와 B+에 대한 이온교환체의 선택성계수라고 한다.
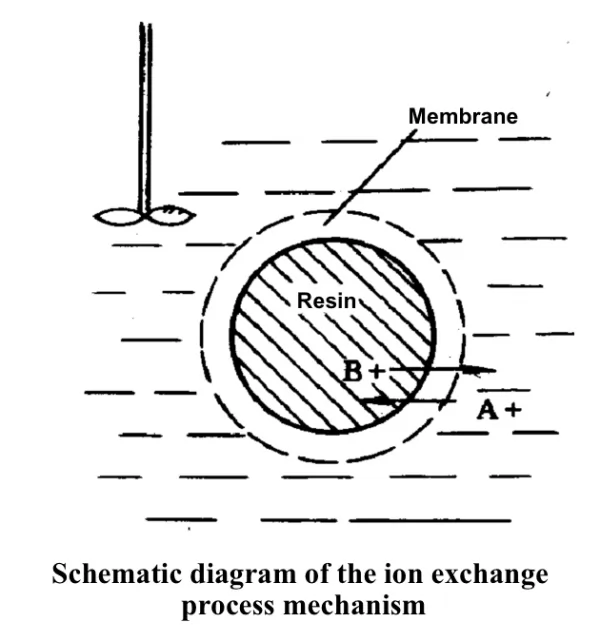
이온 교환 메커니즘:
A+는 용액에서 수지 표면으로 확산됩니다.
A+는 수지 표면에서 수지 내부의 활성 센터로 들어갑니다.
A+는 활성 중심에서 RB와 복분해 반응을 겪습니다.
탈착된 B+ 이온은 수지 내부에서 수지 표면으로 확산됩니다.
B+ 이온은 수지 표면에서 용액으로 확산됩니다.
환율의 제어 단계는 확산 속도이며, 이는 다양한 분리 시스템에서 내부 확산 또는 외부 확산에 의해 제어될 수 있습니다.
이온 교환 과정에 영향을 미치는 요인:
✔입자 크기: 작을수록 빠릅니다.
✔가교도 : 가교도가 낮고 교환속도가 빠름
✔온도: 높을수록 속도가 빨라지며 확산계수의 증가와 관련이 있습니다.
✔이온 원자가: 원자가가 높을수록 확산 속도가 느려집니다.
✔이온 크기: 작을수록 빠릅니다.
✔ 교반 속도 : 어느 정도 클수록 빠릅니다.
✔용액농도 : 확산에 의해 환율을 조절하는 경우 농도가 높을수록 환율이 빨라짐
이온 교환 원리:
양이온 교환 수지를 선택하면 양전하를 띤 물질이 H+와 교환되어 수지에 결합됩니다. 음이온 교환 수지를 선택하면 음전하를 띤 물질이 OH-와 교환되어 수지에 결합될 수 있습니다.
수지에 결합된 물질의 견고성 정도에는 차이가 있으며, 분리, 정제 목적을 달성하기 위해 적절한 용리액을 선택하면 혼합물 중의 성분을 하나씩 용출할 수 있습니다.
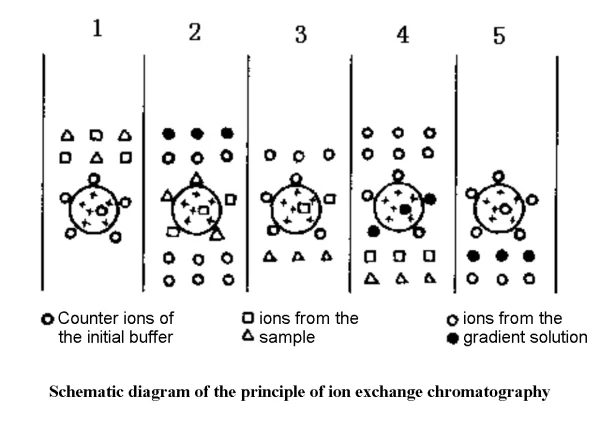
✔1. 평형화 단계: 이온 교환체와 반대 이온의 결합
✔2. 흡착 단계: 시료 및 반대 이온 교환
✔3. 탈착 단계: 경사완충액은 먼저 약하게 흡착된 물질을 씻어내고, 그 다음 강하게 흡착된 물질을 씻어냅니다.
✔4. 재생 단계: 원래의 밸런스 용액으로 완전히 세척하여 재사용 가능
이온 교환 크로마토그래피 수지:
양이온 교환기의 하전된 그룹은 음전하를 띠고 반대 이온은 양전하를 띠므로 용액 내 양이온 또는 양전하를 띤 화합물과 교환 반응을 수행할 수 있습니다.
하전된 그룹의 강도에 따라 강산형(술폰산을 포함하는 그룹, R-SO3H), 중강산형(인산 그룹 또는 아인산 그룹을 포함하는 R-PO3H2)의 세 가지 유형으로 나눌 수 있습니다. ) 및 약산성 유형(카르복실기 및 페놀계 수지, R-COOH 또는 R-벤젠 고리-OH 포함).
이러한 교환기가 교환되는 동안 수소 이온은 다음 공식에 표시된 것처럼 외부 양이온으로 대체됩니다.
R锛岰OOH锛婲a+锛漅锛岰OONa锛嬶紜H+
음이온 교환체는 매트릭스에 4차 아민[-N(CH3)3], 3차 아민[-N(CH3)2], 2차 아민[-NHCH3] 및 1차 아민[-NH2] 그룹을 도입하여 형성됩니다.
아민기의 알칼리도 수준에 따라 각각 강염기성(4급 아미노기 포함), 약염기성(3차 및 2급 아미노기 포함), 중염기성(강염기성 및 2급 아미노기 모두 포함)의 세 가지 유형으로 나눌 수 있습니다. 약한 기본 그룹).
용액 속의 이온과 교환할 때 반응식은 다음과 같다.
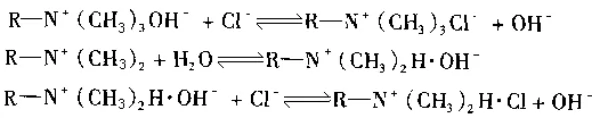
특정 유형의 이온 교환 크로마토그래피 수지에 대한 자세한 내용을 보려면 이온 교환 크로마토그래피에 대한 다음 기사를 계속 지켜봐 주시기 바랍니다.














